Cómo funciona la regeneración?
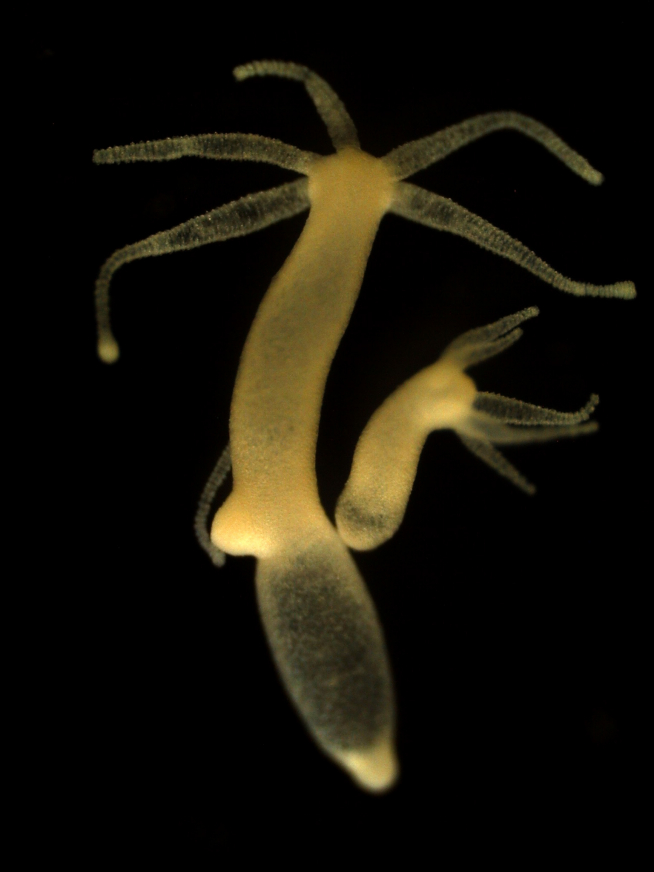
La regeneración de la cabeza o del pie en las hidras es un proceso rápido que se completa en poco menos de un día y medio. Implica el cierre de la herida, el establecimiento de un organizador –un grupo de células encargadas de mantener el patrón y la morfología de una parte del organismo, donde desempeña un papel clave una molécula señalizadora denominada Wnt– y, finalmente, una fase de morfogénesis, en la que el organizador manda señales a las células vecinas para que adopten un estado de diferenciación apropiado para formar la cabeza o el pie y se estructuren en el espacio.
Construir una cabeza
Los científicos han comparado el proceso de formación de una cabeza en las hidras durante la regeneración y durante la gemación. Este último es el modo de reproducción asexual por el que se forma una protuberancia en el cuerpo del animal –una yema– que crecerá y se desarrollará dando lugar a un nuevo organismo. Analizando cómo se modifica la expresión génica, han establecido que los mecanismos de formación de la cabeza en ambos procesos son distintos. En la gemación, los genes se activan de manera gradual, mientras que en la regeneración se producen cambios bruscos: muchos se activan al inicio, después se silencian y se vuelven a activar. Por lo tanto, existe más de una manera de construir una cabeza.
Regulación génica
Los investigadores han identificado una compleja estructura de regulación génica en la que participan unas secuencias de ADN denominadas amplificadoras (‘enhancers’ en inglés) que dirigen la expresión de genes relevantes para la regeneración de la cabeza. El descubrimiento de este tipo de regulación compleja también en las hidras sugiere que su evolución habría tenido lugar hace más de 600 millones de años, antes de la divergencia evolutiva de los cnidarios y de los animales con simetría bilateral (entre los que se encuentran los humanos). Por lo tanto, las hidras son un estupendo modelo para entender cómo funciona la regeneración a escala molecular, antes de poder aplicar estos conocimientos a la medicina.
¿Por qué los mamíferos no pueden regenerarse?
Los biólogos hace tiempo que se preguntan por qué animales como las salamandras pueden regenerar partes de su cuerpo mientras que otros, como los mamíferos, no. Para desentrañar estas diferencias, los científicos buscan a nivel molecular los factores que intervienen en la regeneración y tratan de entender si animales muy alejados evolutivamente emplean o no los mismos trucos.
El grupo de Alejandro Sánchez Alvarado, del Stowers Institute en Kansas City, hace dos décadas que investiga la regeneración en un tipo de gusanos planos, los platelmintos (también conocidos como planarias). Según este investigador, los animales con gran capacidad regenerativa son capaces de activar y desactivar determinados genes para generar nuevos tejidos después de una herida. Por ello, tan importante es identificar los genes implicados en el proceso de regeneración como necesario entender cómo están regulados.
El 2020, publicaron en ‘Science’ un estudio en el que comparaban dos especies de peces de agua dulce que pueden regenerar sus aletas, pero que están separadas por una distancia evolutiva de unos 230 millones de años: el pez cebra (Danio rerio), de origen asiático, y el pez africano Nothobranchius furzeri. Los investigadores cortaron las aletas caudales de ambos peces y analizaron la actividad génica mientras estas volvían a crecer. El objetivo era encontrar un tipo de secuencias cortas de ADN denominadas amplificadoras o potenciadoras (‘enhancers’ en inglés).
Estos ‘enhancers’ son secuencias cortas, de 50 a 1.500 letras de ADN (o pares de bases), que se encuentran por todo el genoma, habitualmente alejadas de los genes, y su función es la de aumentar el nivel de activación de un gen en particular o de un grupo de genes. En ellas se unen unas proteínas –los factores de transcripción– importantes para activar los genes.
En ambas especies de pez, los científicos identificaron ‘enhancers’ que participan en la regeneración, activando genes que promueven el crecimiento de nuevo tejido en respuesta a una herida. También pudieron determinar cuáles de ellos eran particulares de cada especie, y encontraron que unos pocos eran compartidos por ambas. Puesto que las dos especies tienen historias evolutivas distintas, separadas por 230 millones de años, los genes y ‘enhancers’ compartidos están conservados evolutivamente y formarían parte de un programa ancestral de regeneración que podría ser relevante también en otros animales.
Uno de estos ‘enhancers’ regula el gen inhibina beta A (inhba), que se sabe que es importante para la regeneración en los vertebrados. Los investigadores vieron que si se eliminaba el ‘enhancer’ en los peces, perdían completamente la capacidad de regenerar tanto la aleta caudal como su corazón. También identificaron que los mamíferos poseen un ‘enhancer’ equivalente. Pero cuando introdujeron la versión de mamíferos en los peces a los que se les había eliminado su propio ‘enhancer’, no recuperaron su capacidad de regeneración.
Los resultados sugieren que cambios en los ‘enhancers’ ocurridos durante la evolución explicarían la pérdida de capacidad regenerativa en determinadas especies de vertebrados, que solo mantendrían el potencial de responder a las heridas; mientras que otras habrían conservado ambas capacidades.
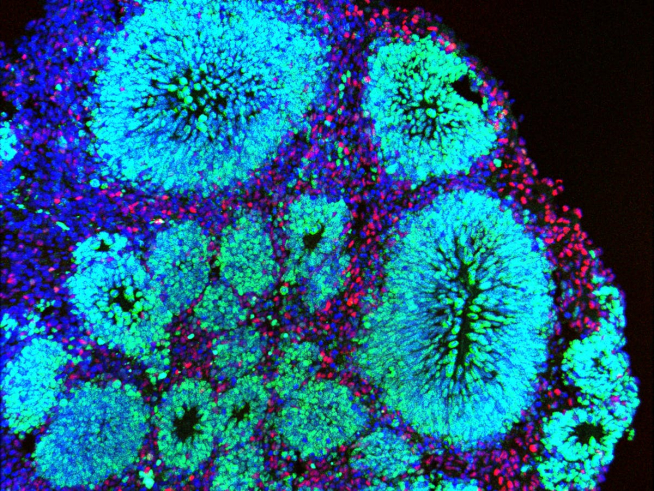
Miniórganos para estudiar y tratar enfermedades
Para que un órgano pueda regenerarse es necesario que las células se dividan y proliferen, crezcan y se diferencien en los tipos celulares necesarios, pero también que se ordenen en el espacio para que el órgano adopte su forma, lo que se conoce como morfogénesis.
En la última década, los científicos intentan recapitular estos procesos en el laboratorio mediante la generación de pequeñas réplicas de órganos humanos, conocidas como miniórganos u organoides, obtenidos a partir de células madre.
En el laboratorio, las células madre –que tienen el potencial de diferenciarse en un sinfín de tipos celulares distintos– se hacen crecer en unas condiciones de cultivo determinadas para permitir que se diferencien y se organicen ellas mismas en estructuras tridimensionales que, tanto por su forma como por su función, se asemejan a un órgano o un tejido real. Por ejemplo, un minirriñón o una copa óptica (una especie de miniojo).
En ellos, los científicos estudian tanto la fisiología normal del órgano como lo que ocurre durante una enfermedad, ya que los organoides pueden obtenerse a partir de las células de un paciente portadoras de una mutación genética. Los miniórganos también sirven para analizar el efecto de los fármacos; y, a largo plazo, podrían emplearse en medicina regenerativa, para reemplazar los tejidos dañados de un paciente.
En este sentido, los científicos se inspiran en la ingeniería de tejidos –que proporciona materiales que sirven de andamiaje a las células y de guía potenciando su capacidad regeneradora–, para obtener organoides que se parezcan cada vez más fisiológica y anatómicamente al órgano real.
Animales distintos, distinto potencial
Las hidras no son los únicos miembros del reino animal que poseen una extraordinaria capacidad regenerativa. Las planarias, un tipo de gusanos planos, regeneran partes de su organismo e incluso uno entero a partir de un pequeño fragmento. A las estrellas de mar les vuelven a crecer los brazos que se desprenden de su disco central y hay especies que completan el proceso inverso: regeneran un cuerpo entero a partir de un brazo perdido. Los cangrejos de río regeneran tanto patas como pinzas.
No existen mamíferos que puedan regenerar totalmente una extremidad, pero en ratones y humanos se ha observado la regeneración de las puntas de los dedos después de ser amputadas. Este fenómeno ocurre solo cuando en el corte se preserva el borde de la uña donde se encuentra una población de células madre capaces de orquestar la regeneración de la yema del dedo, incluyendo hueso, uña y piel.
FUENTE: HERALDO

Comments (2)
betmate
reply
Jones Elizabeth
reply